Francesca De Giorgi, lauréate de l’appel d’offre FRM 2024 « Approches interdisciplinaires pour comprendre les mécanismes fondamentaux des maladies neurodégénératives »

Francesca De Giorgi
Francesca De Giorgi, co-cheffe d’équipe Inserm de l’équipe SynTeam (IMN) a obtenu un financement suite à l’appel d’offre de la FRM pour le projet Approches interdisciplinaires pour comprendre les mécanismes fondamentaux des maladies neurodégénératives.
Toutes nos félicitations !
Laboratoires impliqués
Le consortium regroupe quatre équipes aux expertises complémentaires en neurosciences, biophysique des amyloïdes, biologie de l’ARN, neuroanatomie et neuropathologie :
- Francesca De Giorgi (Coordinatrice) – Équipe 13 SynTeam, IMN, Neurocampus, Bordeaux dédiée à l’étude des synucléinopathies
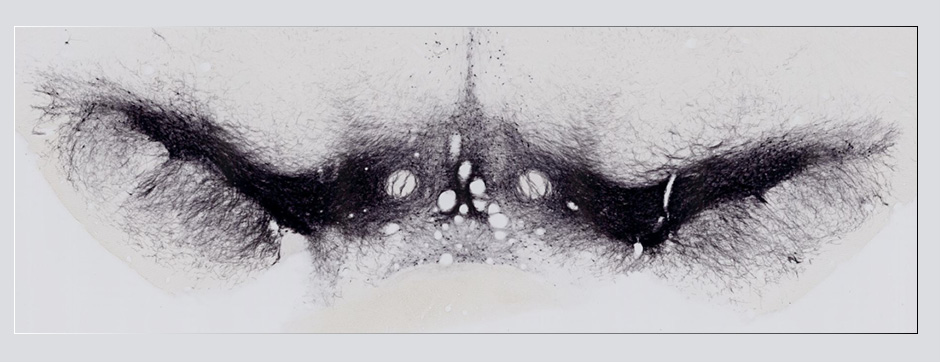
- Marc Landry – Équipe 2, IMN, Neurocampus, Bordeaux spécialiste de neuroanatomie, détection d’ARN in situ
- Cécile Feuillie – Équipe Multiscale Biophysics, CBMN, Pessac, méthodes basées sur l’AFM (incluant AFM-IR) et spectroscopies vibrationnelles (imagerie Raman)
- Fabien Chauveau – Équipe BIORAN, INSERM U1028, Lyon Bron, tomographie par contraste de phase XPCT pour l’étude des amyloïdes en cerveaux entiers
Titre
Un accident nucléaire dans les αSynucléinopathies ?
Projet
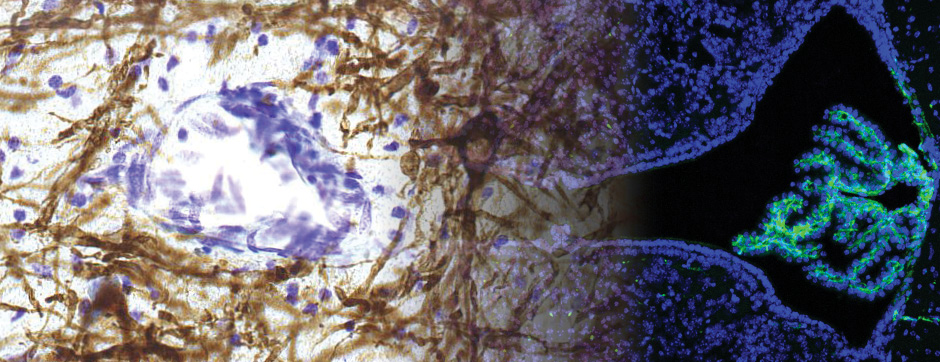
La maladie de Parkinson, l’atrophie multisystématisée et la démence à corps de Lewy sont des maladies neurodégénératives caractérisées par l’agrégation d’alpha-synucléine (aSyn), une petite protéine normalement localisée dans les synapses. Dans ces pathologies, aSyn s’organise en fibrilles rigides qui s’accumulent en inclusions intraneuronales. Les données histopathologiques et expérimentales soutiennent que l’aSyn agrégée est à l’origine de la progression de la maladie via un mécanisme de type prion. Cependant, les effets en aval reliant ces inclusions à la neurodégénérescence restent peu explorés.
Si des dysfonctionnements synaptiques, lysosomiaux ou mitochondriaux ont été proposés comme causes possibles, un impact direct sur la physiologie nucléaire et l’expression génique n’a pas été suffisamment étudié. Nos résultats préliminaires montrent que l’aSyn agrégée perturbe fortement les structures intranucléaires impliquées dans l’épissage et le métabolisme de l’ARN.
Dans ce projet, nous testerons l’hypothèse selon laquelle l’aSyn agrégée, en déstabilisant ces structures nucléaires, altère l’expression de gènes critiques pour l’activité neuronale. En outre, les composants de ces structures, déplacés hors du noyau, pourraient se condenser en complexes ectopiques, servant de plateformes d’agrégation qui amplifient le processus pathologique. Ces plateformes pourraient perpétuer l’agrégation d’aSyn ainsi que celle d’autres protéines neurodégénératives, telles que TAU ou TDP43, en interaction avec des ARN, générant ainsi un cercle vicieux.
Pour tester ces hypothèses, nous utiliserons des approches innovantes de détection biophysique des agrégats et explorerons leur environnement moléculaire dans des modèles expérimentaux in vitro et in vivo. Ce travail permettra d’identifier de nouvelles étapes clefs qui pourraient être ciblées dans des stratégies thérapeutiques futures.
Résultats attendus et contributions originales
L’hypothèse d’un « accident nucléaire » contribuant à la neurodégénérescence dans les synucléinopathies est entièrement novatrice. En utilisant un modèle animal validé de synucléinopathie, nous explorerons en profondeur les effets des inclusions d’aSyn sur l’homéostasie nucléaire.
Notre projet mettra en lumière les interactions potentielles entre les mécanismes de séparation de phases liquides (LLPS), le cross-seeding amyloïde et les altérations de l’épissage dans les processus de neurodégénérescence.
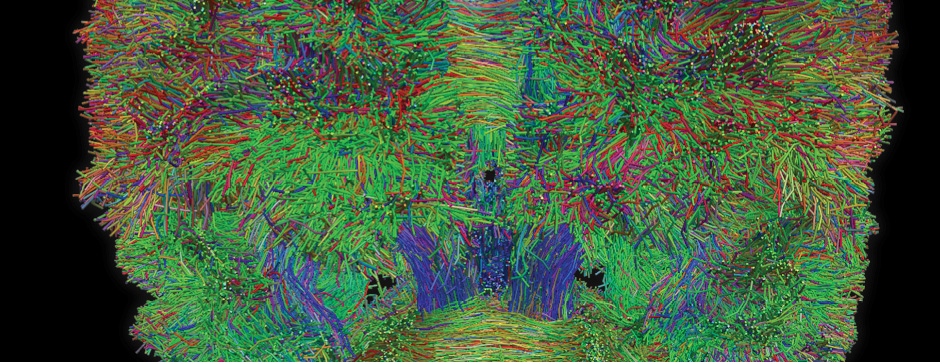
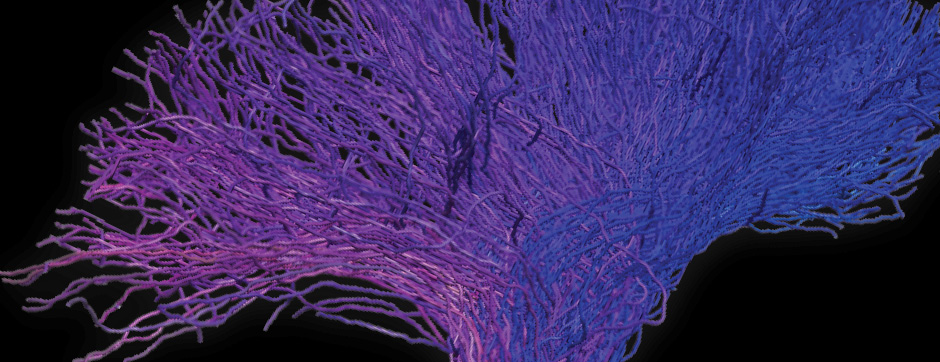
L’intégration de méthodes de pointe (physico-chimie, transcriptomique, protéomique) dans un continuum neuroanatomique 3D permettra une compréhension multiscalaire des perturbations induites par l’aSyn amyloïde dans les neurones.
Les résultats fourniront des mécanismes inédits concernant la perturbation des fonctions nucléaires dans les synucléinopathies et ouvriront de nouvelles perspectives pour identifier les facteurs déclencheurs de la neurodégénérescence. Enfin, l’utilisation de techniques biophysiques innovantes ouvrira un champ encore inexploré pour caractériser l’aSyn amyloïde, à la fois dans son environnement nanométrique et dans un cadre neuroanatomique 3D.